Existen electrodos de trabajo de distinto tipo útiles para distintos cationes o aniones. Cada vez son más usados los electrodos selectivos de iones (ESI) o electrodos de membrana. Uno de los más empleados, que se comenzó a utilizar a principios del siglo XX, es el electrodo de pH (un electrodo de vidrio).
- Electrodo metálico
- Electrodo de membrana cristalina
- Electrodo de vidrio
- Electrodo de membrana líquida
- Electrodo de membrana polimérica
También se emplea la potenciometría en distintas aplicaciones como en sondas sensibles a gases, para valoraciones potenciométricas.
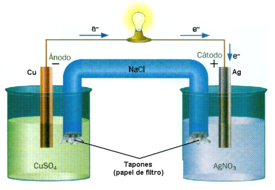
Analizando las realaciones iniciamos con una reacción redox común, que se realiza en forma espontánea, consta de un proceso de oxidación y uno de reducción en los cuales la transferencia de electrones NO ES CONTROLABLE, o sea que dicha transferencia se realiza dentro de la solución (interna).
Si este mismo proceso se realiza separando la oxidación de la reducción mediante el suministro o eliminación de electrones por fuera de la solución, la reacción pasará a ser controlable y a este sistema se lo denomina celda electroquímica.
Las celdas electroquímicas son dispositivos que se utilizan para transformar energía química en eléctrica, o para producir sustancias. El proceso involucrado puede ser una reacción química ordinaria, la transferencia de una especie química de un nivel de concentración a otro, etc. El requisito esencial es que debe ser posible realizarlo como resultante de un proceso de oxidación y otro de reducción, cada uno de los cuales ocurre separadamente en un electrodo apropiado.
De la definición dada anteriormente se desprende que el proceso que tiene lugar en una celda electroquímica es termodinámicamente irreversible. Para que puedan aplicarse al mismo los conceptos de la Termodinámica clásica se debe lograr que las pilas sean capaces de actuar en forma reversible, para lo cual es indispensable que el proceso sea infinitamente lento. Lo que se hace es medir la diferencia de potencial entre los electrodos de la celda electroquímica por el método potenciométrico. Éste permite reducir la corriente que circula por la celda electroquímica hasta un nivel para el cual se logre una aproximación adecuada al comportamiento reversible (concepto de reversibilidad termodinámica). En estas condiciones, la celda electroquímica se denomina pila.
La ecuación de Nernst se nombra después del químico físico alemán Walther Nernst que primero la formuló. Esta ecuación conecta el potencial reversible real de un electrodo, E, al potencial reversible estándar de los pares del electrodo, E0.
En su forma más fundamental se escribe la ecuación de Nernst como:
E = E0- ln (RT/zF) (a(RED)/a(OX))
donde R es la constante universal de los gases, T es la temperatura absoluta, z es la carga o número electrones en juego, y F es la constante de Faraday. La notación a(RED) representa las actividades químicas de todas las especies que aparecen en la cara reducida de la reacción y la notación a(OX) representa las actividades químicas de todas las especies que aparecen en la cara oxidada de la reacción.
Algunas de las especies que participan en reacciones del electrodo son compuestos sólidos puros y compuestos puros del líquido. En soluciones acuosas diluidas, el agua se puede tratar como líquido puro porque la cantidad de agua es tanto mayor que la cantidad cualquier otra cosa. Para un sólido puro o líquido puro, actividad es constante, así que en la ecuación de Nernst su valor se considera uno. Las actividades de gases se toman generalmente como sus presiones parciales y las actividades de solventes tales como iones se toman generalmente como sus concentraciones molares, la ecuación de Nernst se escribe menudo a con gas, sólido o líquido puros, en forma:
E = E0 - ln (RT/zF) (c(RED)/c(OX)), o
E = E0 - ln (RT/zF) ([ RED]/[OX ])
entender, sin embargo, que actividad del sólido puro compuesto o del líquido puro se debe tomar como igual uno y que actividad gas se debe tomar como igual a su parcial presión.
A 298,15 oK (25oC), valor constante y conversión logaritmo base e (ln) a logaritmo base diez (log) poder ser combinar para dar uno simple forma ecuación de Nernst:
E = E0 - log (0.05915/z) (a(RED)/a(OX)), o
E = E0 - log (0.05915/z) ([ RED]/[OX ])
Las formas de la ecuación de Nernst introducida en la sección anterior se pueden aplicar a los potenciales de electrodos individuales y de las diferencias potenciales a través de las células.
Una de las aplicaciones más importantes de la Potenciometría, en cuanto a química es medir el pH:
1. El principio básico de la medida electrométrica del pH se fundamenta en el registro potenciométrico de la actividad de los iones hidrógeno por el uso de un electrodo de vidrio y un electrodo de referencia, o un electrodo combinado. La fuerza electromotriz (fem) producida por el sistema electroquímico varía linealmente con el pH y puede verificarse por la obtención de una gráfica de pH vs. fem para diferentes soluciones de pH conocido. El pH de la muestra se determina por interpolación.
2. El método es aplicable a aguas potables, superficiales, y salinas, aguas residuales domésticas e industriales y lluvia ácida.
3. En cuanto a avances tecnologicos el principio de este concepto tiene aplicacion directa en la elctronica donde se usa regularmente como ajustador o controlador de energia de entrada o de salida, ya sea un voltaje, corriente, sonido, etc.
*
ESPECTROFOTOMETRIA.
La espectrofotometría es el método de análisis óptico más usado en las investigaciones biológicas. El espectrofotómetro es un instrumento que permite comparar la radiación absorbida o transmitida por una solución que contiene una cantidad desconocida de soluto, y una que contiene una cantidad conocida de la misma sustancia.
Todas las sustancias pueden absorber energía radiante, aun el vidrio que parece ser completamente transparente absorbe longitud de ondas que pertenecen al espectro visible; el agua absorbe fuertemente en la región del infrarrojo.
La absorción de las radiaciones ultravioleta, visibles e infrarrojas depende de la estructura de las moléculas, y es característica para cada sustancia química. Cuando la luz atraviesa una sustancia, parte de la energía es absorbida; la energía radiante no puede producir ningún efecto sin ser absorbida. El color de las sustancias se debe a que éstas absorben ciertas longitudes de onda de la luz blanca que incide sobre ellas y solo dejan pasar a nuestros ojos aquellas longitudes de onda no absorbidas.
La espectrofotometría proveniente del sol, es decir la radiacion ultravioleta-visible usa haces del espectro electromagnético y radiaciones del campo UV de 80 a 400 nm, principalmente de 200 a 400 nm y usa haces de luz visible de 400 a 800 nm , por lo que es de gran utilidad para caracterizar las soluciones en la región ultravioleta y visible del espectro.
Al campo de luz uv de 200 a 400 nm se le conoce también como rango de uv cercano , la espectrofotometría visible solamente usa el rango del campo electromagnético de la luz visible , de 400 a 800 nm. A este tipo de técnicas se conoce en conjunto como técnicas fisico-bioquímicas , en relación a la espectrofotometría se tiene una ley muy importante la ecuación de Beer-Lambert:
it/io=10-klc
donde it , es la intensidad de luz que sale de la cubeta y que va a llegar a la celda fotoeléctrica o detector donde es captada, medida y transformada en unidades de absorbancia o de densidad óptica, io es la intensidad incidente , k es la capacidad de la muestra para la captación del haz del campo electromagnético, l es la longitud de la cubeta de espectrofotometría que recorre la radiación, y c es la concentración de la muestra ya ubicada en la cubeta.
La ecuación simplificada de la ley de Beer-Lamber comprende a la mínima ecuación que relaciona la concentración , la absorbancia de la muestra y el factor de calibración. El factor de calibración relaciona la concentración y la absorbancia de los estándares. Aparte del método de espectrofotometria y fotocolorimetria se tiene los métodos de centrifugación diferencial, radioimnue, electroforesis, análisis de sedimentación, etc.
Es decir se refiere a la medida de cantidades relativas de luz absorbida por una muestra, en funcion de la longitud de onda. Cada componente de la solucion tiene su patron de absorcion de luz caracteristico. Comparando la longitud de onda y la intensidad del maximo de absorcion de luz de una muestra versus soluciones standard, es posible determinar la identidad y la concentracion de componentes disueltos en la muestra (solucion incognita).
Las ventajas de la espectrofotometria sobre otros metodos analiticos de laboratorio son varias: es rapida, precisa, versatil, facil de usar y eficiente en costo. Los espectrofotomentros se han mejorado en precision y versatilidad en los ultimos años con los avances de tecnologia, y hoy se consideran indispensables en un laboratorio de quimica analitica.
La espectrofotometria se usa para diversas aplicaciones, como :
- Analisis cuantitativo y cualitativo de soluciones desconocidas en un laboratorio de investigacion,
- Estandarizacion de colores de diversos materiales, como plasticos y pinturas,
deteccion de niveles de contaminacion en aire y agua, - Y determinacion de trazas de impurezas en alimentos y en reactivos.
Un espectrometro tipico posee cuatro componentes basicos: una fuente de radiacion que tiene intensidad constante en el rango de longitud de onda que cubre ( usualmente es lampara de tungsteno para luz visible,y deuterio para ultravioleta), un compartimiento para la muestra, un monocromador que separa la banda de longitud de onda deseada del resto del espectro y la dispersa al compartimiento de la muestra, y un fotodetector, que mide cuantitativamente la radiacion que pasa por la muestra.
En general, los espectrometros miden en % de transmitancia (T) y absorbancia (A). El porciento de transmitancia se refiere a la cantidad de radiacion que pasa a traves de la muestra y alcanza el detector. Una solucion limpida, no absorbente, mostrara una lectura de 100% de transmitancia en un espectrofotometro calibrado. Las unidades de absorbancia van de 0 a 2. La absorbancia se relaciona con la transmitancia como: A =- log 1/T, (logaritmo decimal).
CROMATOGRAFIA.
La cromatografía es un conjunto de técnicas basadas en el principio de retención selectiva cuyo objetivo es separar los distintos componentes de una mezcla y en algunos casos identificar estos si es que no se conoce su composición.
Las técnicas cromatográficas son muy variadas, pero en todas ellas hay una fase móvil que consiste en un fluido (gas, líquido o fluido supercrítico) que arrastra a la muestra a través de una fase estacionaria que se trata de un sólido o un líquido fijado en un sólido. Los componentes de la mezcla interaccionan en distinta forma con la fase estacionaria y con la fase móvil. De este modo, los componentes atraviesan la fase estacionaria a distintas velocidades y se van separando. Después de haber pasado los componentes por la fase estacionaria y haberse separado pasan por un detector que genera una señal que puede depender de la concentración y del tipo de compuesto.
Las distintas técnicas cromatográficas se pueden dividir según cómo esté dispuesta la fase estacionaria:
- Cromatografía plana. La fase estacionaria se sitúa sobre una placa plana o sobre un papel. Las principales técnicas son: Cromatografía en papel y Cromatografía en capa fina.
- Cromatografía en columna. La fase estacionaria se sitúa dentro de una columna. Según el fluido empleado como fase móvil se distinguen: Cromatografía de líquidos, Cromatografía de gases y Cromatografía de fluidos supercríticos.
La cromatografía de gases es útil para gases o para compuestos relativamente volátiles, lo que incluye a numerosos compuestos orgánicos. En el caso de compuestos no volátiles se recurre a procesos denominados de "derivatización", a fin de convertirlos en otros compuestos que se volatilizen en las condiciones de análisis.
Dentro de la cromatografía líquida destaca la cromatografía líquida de alta resolución (HPLC, del inglés High Perfomance Liquid Chromatography), que es la técnica cromatográfica más empleada en la actualidad, normalmente en su modalidad de fase reversa, en la que la fase estacionaria tiene caracter no polar, y la fase móvil carácter polar (generalmente agua o mezclas con elevada proporción de la misma, o de otros disolvente polares, como por ejemplo metanol). Una serie eluotrópica, es un rango de sustancia de diferentes polaridades que actúan como fase móvil y que permiten observar un mejor desplazamiento sobre una fase estacionaria.
El botánico ruso Mikhail Tsvett (Mikhail Semenovich Tsvett, 1872-1919) empleó por primera vez en 1906 el término "cromatografía" (que proviene del griego χρομα y γραφω que significan respectivamente "color" y "escribir").
A comienzos del año 1903, Mikhail Tswett usó columnas de adsorción de líquidos para separar pigmentos vegetales (por ejemplo, clorofilas). Las disoluciones se hacían pasar a través de una columna de vidrio rellena de carbonato de calcio, que finamente dividido de un material poroso que interacciona de forma diferente con los componentes de la mezcla, de forma que éstos se separaban en distintas bandas a lo largo de la columna.
Los primeros equipos de cromatografía de gases aparecieron en el mercado a mediados del siglo XX. A su vez, la cromatografía líquida de alta resolución (HPLC) comenzó a desarrollarse en los años 1960, aumentando su importancia en las décadas siguientes, hasta convertirse en la técnica cromatográfica más empleada. Sin embargo esto se irá modificando con el paso de los años.
Aunque desde tiempos antiguos los fabricantes de colorantes probaban sus mezclas sumergiendo en ellas pedazos de cuerdas o tela y mirando las diferentes bandas de color dejadas por el líquido en su ascenso, el descubrimiento de esta ciencia, en 1910, corresponde al botánico ruso Mikhail Tsvet, quien reconoció las bases fisicoquímicas de la separación y las aplicó en su experimento de separación de los pigmentos de las plantas. Dado que trabajó con substancias coloreadas, bautizó el método como cromatografia.
La técnica se basa en la diferente velocidad de adsorción de los componentes de una mezcla ( llamada fase móvil y que puede ser un gas, un líquido o un fluído) que se mueve por un medio poroso (llamado fase estacionaria y que puede ser líquido o sólido) arrastrado por un disolvente en movimiento. Los componentes que se adsorben menos avanzan más rápido por la columna, en tanto que los que se adsorben más van quedando rezagados.
El cromatógrafo, que es el instrumento utilizado para realizar la coromatografía, detecta el cambio de conductividad eléctrica que produce la llegada de los distintos gases al final de la columna convirtiéndolos en una señal gráfica o cromatograma. La identificación cualitativa, esto es la presencia en el compuesto, de un componente cualquiera se basa en el tiempo de retención o tiempo que tarda en aparecer al final de la columna, el que es específico para cada elemento químico. El análisis cuantitativo, es decir determinar las cantidades en que se encuentra la substancia, es más complicado pues requiere el cálculo del área de la señal, o pico, dejada por el gas, la cual será proporcional a la concentración del componente.
La cromatografía se utiliza ampliamente en una gran cantidad de disciplinas, pues permite detectar elementos de cualquier peso molecular: desde un virus, que tiene varios millones de átomos, hasta el hidrógeno, que sólo tiene dos. Dado que puede detectar presencias a nivel del picogramo, es decir 0,000000000001 gramos, es ampliamente usada en técnica forense para rastrear drogas o substancias tóxicas. Comprueba por ti mismo la eficacia del método viendo las aplicaciones prácticas mostradas en el link de referencia de cromatografía.
Actividad 10:
Desarrollar una investigación previa por parte del alumno sobre los métodos fisicoquímicos y crear un debate de los métodos así como el análisis de sus aplicaciones en el mundo real.
Referencias:
- Potenciometría. Recopilado en Oct. 20, 2008 de: http://www.agr.ucv.ve/catedras/quimica/quimica3/temario.html
- Potenciometría. Recopilado en Oct. 20, 2008 de:
http://dilillo.blog.cotas.net/2008/05/14/potenciometria/
- Espectrofotometría. Recopilado en Oct. 20, 2008 de:
http://www.frlp.utn.edu.ar/materias/qcasis/mostracion2.html
- Espectrofotometría. Recopilado en Oct. 20, 2008 de:
www.frlp.utn.edu.ar/grupos/aepeq/leyes.pps
- Cromatografía. Recopilado en Oct. 20, 2008 de: http://ciencias.ucv.cl/micro/croma/indexcro.htm
- Cromatografía. Recopilado en Oct. 20, 2008 de:
http://ciencias.ucv.cl/micro/croma/cro1.htm