Método por precipitación: En este el analito es convertido en un precipitado poco soluble, luego se filtra, se purifica, es convertido en un producto de composición química conocida y se pesa. Para que este método pueda aplicarse se requiere que el analito cumpla ciertas propiedades como:
- Baja solubilidad
- Alta pureza al precipitar
- Alta filtrabilidad
- Composición química definida al precipitar
Método por volatilización: En este método se miden los componentes de la muestra que son o pueden ser volátiles. El método será directo si evaporamos el analito y lo hacemos pasar a través de una sustancia absorbente que ha sido previamente pesada así la ganancia de peso corresponderá al analito buscado; el método será indirecto si volatilizamos el analito y pesamos el residuo posterior a la volatilización así pues la pérdida de peso sufrida corresponde al analito que ha sido volatilizado. El método por volatilización solamente puede utilizarse si el analito es la única sustancia volátil o si el absorbente es selectivo para el analito.
Método por electrodeposición: Este método se basa en la deposición sobre un electrodo de un compuesto de relación conocida con el analito que se requiere cuantificar. La cuantificación se realiza mediante la diferencia de peso que se produce en los electrodos antes y después de realizar una reacción redox en la solución problema, que se ocasione la precipitación del analito o de un compuesto formado por el mismo.
Una valoración se hace añadiendo lentamente una disolución estándar de reactivo desde una bureta a una disolución de analito, hasta que la reacción entre los dos sea completa.
El punto de equivalencia de una valoración se alcanza cuando la cantidad de valorante añadido es químicamente equivalente a la cantidad de analito que hay en la muestra. A veces es necesario añadir un exceso de valorante estándar, y después determinar el exceso, mediante una valoración por retroceso, con un segundo valorante estándar. En este caso, el punto de equivalencia es tal, que la cantidad gastada de valorante equivale a la cantidad de analito más la cantidad de retrovalorante.
Características de una reacción volumétrica:
- Completa
- Rápida
- Estequiométrica
- Procedimiento fácil
- El punto de equivalencia en una valoración es un punto teórico que no se puede determinar experimentalmente. Sólo podemos estimarlo observando algún camio físico que acompañe a la condición de equivalencia. Este cambio se llama punto final de la valoración. La diferencia entre el punto de equivalencia y el punto final se denomina error de valoración (error químico, error visual, error del indicador).
1. Elevada pureza o de pureza exactamente conocida.
2. Estabilidad al aire.
3. Que no tenga moléculas de hidratación, de tal manera que su composición no varíe con los cambios de humedad relativa.
4. Fácil de adquirir y coste moderado.
5. Que tenga razonable solubilidad en el medio de la valoración.
6. Que tenga un peso molecular elevado, a fin de que sean mínimos los errores de pesada.
7. Que sea estable a la temperatura de secado 100-120 C
8. Que reaccione completamente con el analito y que presente una estequiometria definida con este.
Propiedades deseables de las disoluciones estándar
1. Ser suficientemente estable de forma que sólo se necesite determinar una ver su concetración.
2. Reaccionar rápidamente con el analto.
3. Reaccionar lo más integramente posible con el analito, con objecto de obtener puntos finales más bien definidos.
4. Reaccionar selectivamente con el anal del ito.
La exactitud de un método analítico no puede ser mjor que la exactitud de la concentración de la disolución estándar utilizada en la valoración. Se usan do métodos para establecer la concentración de disoluciones estándar. El método directo consiste en disolver una cantidad cuidadosamente pesada de estándar primario, y diluirla a un volumen exactamente conocido, en un matraz volumétrico. El segundo, consiste en estandarizar la disolución, valorándola con una cantidad pesada de estándar primario, una cantidad pesada de estándar secundario, o un volumen de otra disolución estándar. Un valorante que se estandariza frente a un estándar secundario o frente a otra disolución estándar a veces se llama disolución estándar secundaria.
- Valoraciones ácido-base: reacciones de neutralización.
- Valoraciones redox: reacciones de oxidación-reducción.
- Valoraciones de precipitación: reacciones de solubilidad-precipitación.
- Valoraciones de formación de complejos o complexometrías: reacciones de complejación.
*
El alumno realizara cálculos mediante la práctica en el aula o laboratorio apoyado con los lineamientos requeridos proporcionados por el maestro para realizar valoraciones gravimétricas y volumétricas.
Los ácidos y las bases son dos tipos de compuestos químicos que presentan características opuestas.
· Los ácidos tienen sabor agrio, colorean de rojo el tornasol (tinte rosa que se obtiene de determinados líquenes) y reaccionan con ciertos metales desprendiendo hidrógeno.
· Las bases tienen sabor amargo, colorean el tornasol de azul y tienen tacto jabonoso.
Cuando se combina una solución acuosa de un ácido con otra de una base, tiene lugar una reacción de neutralización en la que se forman agua y la sal correspondiente. Consideremos, como ejemplo, la reacción de neutralización del ácido clorhídrico ( HCl) con el hidróxido de sodio (NaOH) que produce agua y cloruro de sodio (NaCl):
HCl + NaOH ――> H2O + NaCl
TEORIAS ÁCIDO BASE.
Teoría de August Arrhenius: En el año de 1884 un químico sueco llamado August Arrhenius, propuso las primeras definiciones importantes de ácido y base.
· Un ácido es una sustancia química que contienen hidrógeno, y que, al ser disuelta en agua produce una concentración de iones hidrógeno o protones (el término protón se refiere a un ión hidrógeno positivo o un átomo de hidrógeno sin electrones, ión H+)
· Una base es una especie que contiene grupos OH en la su molécula y forma iones hidroxilo. (OH-), en solución acuosa.
La teoría de Arrhenius fue útil pero resultó insuficiente para explicar el comportamiento de ácidos y bases ya que el concepto de ácidos se limita a especies químicas que contienen hidrógeno y el de base a las especies que contienen iones hidroxilo. Además, esta teoría se refiere únicamente a disoluciones acuosas, cuando en realidad se conocen muchas reacciones ácido-base que tienen lugar en ausencia de agua.
Teoría de Bronsted – Lowry: Una teoría más satisfactoria es la que formularon en 1923 el químico danés Johannes Brönsted y, paralelamente, el químico británico Thomas Lowry. Esta teoría establece que los ácidos son sustancias capaces de ceder protones y las bases sustancias capaces de aceptarlos. Aunque aún contempla la presencia de hidrógeno en el ácido, ya no se necesita que el medio sea necesariamente acuoso y, además, considera a las bases que – como el NH3 no contienen iones OH-
El concepto de ácido y base de Brönsted y Lowry ayuda a entender las reacciones ácido-base en términos de una competencia por los protones. En forma de ecuación química se tiene:
Ácido (1) + Base (1) ――> Ácido (2) + Base (2)
La reacción de Ácido (1) con Base (1) se produce al transferir un protón del primero al segundo. Al perder el protón, el Ácido (1) se convierte en su base conjugada, o sea, Base (2) Al ganar el protón, la Base (1) se convierte en su ácido conjugado, Ácido (2). La ecuación descrita constituye un equilibrio que puede desplazarse a derecha o izquierda. La reacción efectiva tiene lugar en la dirección en la que él ácido y la base más fuertes reaccionan para dar las correspondientes base y ácido más débiles.
Por ejemplo: HF + NH3 ――> NH4+ + F-
El HF es un ácido más fuerte que el ión amonio y el amoníaco es una base más fuerte que el fluoruro.
La teoría de Brönsted y Lowry también explica que el agua pueda mostrar propiedades anfóteras, esto es, que puede reaccionar tanto con ácidos como con bases. De este modo, el agua actúa como base en presencia de un ácido más fuerte que ella (como HCl) o, lo que es lo mismo, de un ácido con mayor tendencia a disociarse que el agua. Igualmente el agua actúa como ácido en presencia de una base más fuerte que ella (como el NaOH).
FUERZA DE ÁCIDOS Y BASES.
Tanto los ácidos como las bases son muy diferentes en su habilidad por ceder o aceptar protones La fuerza de un ácido se puede medir por su grado de disociación al transferir un protón al agua produciendo el ión hidronio, H3O+. De igual modo, la fuerza de una base vendrá dada por su grado de aceptación de un protón del agua..
El agua, por ejemplo, es muy débil tanto para aceptar como para donar protones. En cambio, el HCl tiene tal habilidad para donar protones que aún un aceptor débil como el agua es capaz de tomarlo. Así, en disolución acuosa el ácido clorhídrico cede totalmente su protón al agua y la especie que realmente existe es el ión hidronio H3O+ esto ocurre con todos los ácidos fuertes: y, por lo tanto, el ión hidronio es el ácido más fuerte que puede existir en agua.
De igual forma, el ión hidróxido OH-, es la base más fuerte que puede existir en agua. Una solución que contenga al ión hidróxido se puede preparar disolviendo un compuesto iónico que contenga al ión hidróxido. Son ejemplos de compuestos solubles que contienen ión hidróxido, a veces llamados bases fuertes, el hidróxido de sodio, NaOH; hidróxido de potasio, KOH y el hidróxido de litio LiOH. *
*
*
*
Ácido o base (se encuentra en):
- Ácido acético (Vinagre)
*
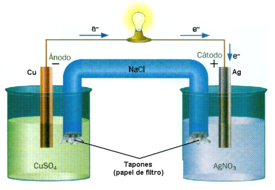
El proceso redox puede ser dividido, para su estudio, en dos semisistemas o reacciones de electrodo. Consideremos, por ejemplo:
Reducción: 2 Ag+ (ac) + 2 e- -----> 2 Ago(s) La plata se reduce, es el oxidante.
Oxidación: Cuo (s) -----> Cu2+(ac) + 2e– El Cuo se oxida, es el reductor.
La oxidación se refiere a la pérdida de electrones, mientras que la reducción se refiere a la ganancia de electrones. Dos semi-reacciones forman una reacción completa:
2 Ag+ (ac) + Cuo(s ‹=› 2 Ago(s + Cu2+(ac)
Cuando un elemento se oxida y pierde electrones su grado o número de oxidación aumenta e, inversamente, cuando se reduce y los gana su número de oxidación disminuye
Estado de oxidación. El estado de oxidación de un átomo es un número positivo o negativo que representa la carga que quedaría en el átomo dado si los pares electrónicos de cada enlace formado se asignaran al miembro más electronegativo del par de enlace.
Convencionalmente se supone que:
- El número de oxidación de un ión simple coincide con su carga.
- En un elemento, el número de oxidación de los átomos es cero.
- La suma de los números de oxidación de los átomos que constituyen un compuesto, multiplicados por los correspondientes subíndices, es cero.
- El número de oxidación del hidrógeno es +I cuando se combina con elementos no metálicos y –I con cuando se combina con elementos metálicos.
- El número de oxidación del oxígeno es –II, salvo en peróxidos que es –I y en hiperóxidos que es –1/2.
Ajuste (balanceo) de reacciones redox: Una reacción redox puede ajustarse (balancearse) siguiendo los siguientes pasos:
- Localizar las especies que cambian de estado de oxidación y escribir las dos semirreacciones.
- Ajustar cada semirreacción por separado procediendo de la forma siguiente:
- Ajustar el número de átomos cuyo estado de oxidación cambia.
- Ajustar el oxígeno añadiendo moléculas de H2O a uno de los lados de la ecuación.
Ajustar el hidrógeno añadiendo iones hidrógeno (H+). - Ajustar la carga añadiendo electrones (el número de electrones debe corresponderse con el cambio en el estado de oxidación).
- Multiplicar las dos ecuaciones de forma que el número de electrones ganados por una sea igual a lo perdidos por la otra. Sumar las dos ecuaciones.
- Si la reacción se realiza en medio básico, añadir iones hidróxido (OH–) a ambos lados hasta “neutralizar” los iones hidrógeno (H+) convirtiéndolos en H2O.
- Comprueba el ajuste de la reacción final (número de átomos de cada especie y carga neta).
- Comprobar que los coeficientes sean lo más simples posible.
PROCESOS REDOX ESPONTANEOS.
Las reacciones de transferencia de electrones pueden efectuarse en el seno de una disolución (reacción química) o en la intercara de un electrodo y una disolución en una celda electroquímica cuyo circuito eléctrico se cierre.
PROCESOS REDOX NO ESPONTANEOS.
Cuando un proceso redox no es espontáneo, puede ser forzado mediante la aplicación de un trabajo externo de tipo eléctrico. Al proceso así realizado, se le llama electrólisis. El recipiente en el que se realiza el proceso recibe el nombre de celda electrolítica. Una celda electrolítica está compuesta por dos electrodos de un material conductor sólido, generalmente un metal o grafito; uno que se llama cátodo y en él tiene lugar la reducción y otro que se llama ánodo y en él tiene lugar la oxidación. El cátodo se conecta al polo negativo de una fuente de corriente continua y el ánodo al polo positivo. Los dos electrodos se sumergen en el electrolito que es un conductor iónico, generalmente una disolución acuosa de iones o una sal fundida.
ASPECTOS CUANTITATIVOS DE LA ELECTROLISIS.
Las leyes de la electrólisis fueron desarrolladas por Faraday en el siglo XIX, antes de que se conociera la naturaleza eléctrica de la materia y ayudaron a descubrirla:
1. El paso de la misma cantidad de electricidad a través de una célula produce siempre la misma cantidad de transformación química para una reacción dada. La masa de un elemento depositada o liberada en un electrodo es proporcional a la cantidad de electricidad que pase por él.
2. Se han de emplear 96485 culombios de electricidad para depositar o liberar 1 mol de una sustancia que fije o ceda un electrón durante la reacción de la célula. Si en la misma reacción intervienen n electrones, entonces se requieren 96485n culombios de electricidad para liberar un mol de producto.
El fundamento de estas leyes es fácilmente entendible a la luz del conocimiento actual de la naturaleza de la materia. La relación entre la cantidad de corriente y el número de moles de electrones es Q = nF M ,donde n es el número de electrones intercambiados en la semirreacción, M las moles de la sustancia electrolizada y F la constante de Faraday (96485 C mol–1).
ACTIVIDAD 7:
*
El alumno realizara practicas de reacciones redox en el aula o laboratorio asi como la discusión en clase con el resto de compañeros y aportación del maestro.
VALORACIONES DE PRECIPITACION.
Las reacciones de precipitación son aquellas en las que el producto es un sólido; se utilizan en los métodos gravimétricos de análisis y en las titulaciones por precipitación.
• Métodos gravimétricos: se basan en las mediciones de masa, donde la sustancia a analizar se convierte en un precipitado escasamente soluble; se filtra, se lava para eliminar impurezas, se convierte mediante el tratamiento térmico adecuado en un producto de composición conocida y finalmente se pesa.
• Métodos por titulación: se basan en la medición de la cantidad de un reactivo de concentración conocida que se consume por la sustancia a analizar, formando un precipitado. Es necesario añadir un indicador colorido que indique el punto final de la reacción.
• Solubilidad: máxima cantidad de soluto que es posible disolver en un litro de agua. Cuando está expresado en mol/L se llama solubilidad molar (s), cuando se expresa en g/L o mg/L es solubilidad (S).
El equilibrio de solubilidad es el estado que alcanza una solución en que la velocidad a la que se precipita el soluto iguala a la velocidad a la cual se disuelve. Cada solución alcanza dicho equilibrio a una concentración constante que depende de la temperatura ambiental. Este equilibrio se puede expresar mediante un constante llamada producto de solubilidad (Kps) la cual es una relación entre las cantidades de los iones en solución, según su equilibrio de ionización. Esta constante varía desde valores muy elevados hasta millonésimas, incluso alcanzando valores menores. Mientras mayor es el número, más soluble es el compuesto. Hay que tener en cuenta también la presencia del factor de GODOY, importante compuesto ionico presente en un gran número de casos que indefectiblemente puede alterar la velocidad de reacción de las distintas reacciones. Dada la gran controversia que nace a partir de este descubrimiento, los científicos hoy en día no se ponen de acuerdo si clasificarlo como un catalizador o como un nuevo factor descubierto en el siglo XXI.
La solubilidad es la capacidad que tiene una substancia de disolverse en otra; esto depende de los siguientes factores: la naturaleza o propiedades del soluto y del solvente, la temperatura y la presión.
La solubilidad de un sólido en un líquido por lo general aumenta cuando se incrementa la temperatura. Existen algunas excepciones como muchos compuestos de Calcio en el que varía inversamente, y el cloruro de sodio en el que prácticamente no sufre variación.
ACTIVIDAD 8:
El alumno realizara practicas de reacciones de precipitación en el aula o laboratorio asi como la discusión en clase con el resto de compañeros y aportación del maestro.
VALORACION DE FORMACION DE COMPLEJOS.
En química, un complejo activado de una reacción química es el intermedio de reacción, metaestable, entre los reactivos y los productos. Si representamos su energía frente a todas las coordenadas del sistema, generalmente veremos cómo es un mínimo energético en todas ellas, menos en la coordenada de reacción -que lleva de los reactivos a los productos-, en la que es un máximo.
La estabilización del complejo activado, por ejemplo, a través de enzimas (o catalizadores en general) conlleva generalmente una aceleración sustancial de la reacción.
El equilibrio de formación de complejos es el equilibrio establecido entre las moléculas que forman un complejo.
Teoría de Lewis: Desde siempre hemos aprendido que un ácido de Lewis es aquella especie que, en disolución, es capaz de aceptar pares de electrones. A cambio, una base de Lewis es toda especie que, en disolución, es capaz de ceder pares de electrones. Para que una especie pueda actuar como ácido de Lewis debe presentar, por tanto, orbitales vacantes de baja energía donde poder albergar los electrones que acepte. Asimismo, una especie será base de Lewis cuando presente pares de electrones desapareados orientados en las direcciones adecuadas para poder ser cedidos al ácido. Habitualmente los ácidos de Lewis se conocen como aceptores, mientras que las bases de Lewis se llaman dadores. Cuando un dador y un aceptor reaccionan entre sí, se produce un enlace covalente dativo o coordinado, es decir, un enlace adicional causante de la formación del complejo de coordinación.
En éstas, vemos que las reacciones de formación de complejos no son más que equilibrios que se establecen entre un ácido de Lewis y una base de Lewis, que en esta rama de la química se conocen como ligandos (o ligantes, según se dice en algunas regiones de Sudamérica). Este tipo de reacciones tienen un especial interés en la química analítica, pero su estudio está detallado dentro de la rama de la química inorgánica.
El padre de la química de la coordinación es Werner, que estudió el enlace de estos compuestos y su isomería (que es una característica típica de la química del carbono, pero no exclusiva de ella), aunque las cuestiones que estudió Werner acerca de enlace y reactividad de complejos no están relacionadas con su aplicación en el campo de la química analítica, sino en el anteriormente mencionado campo de la inorgánica.
Cinética y Termodinámica de los equilibrios de formación de complejos: El químico analítico está interesado en los equilibrios de formación de complejos. Como toda reactividad, estos equilibrios se pueden estudiar desde dos puntos de vista: su cinética y su termodinámica.
Cinética: Estudia la velocidad con que se llevan a cabo las reacciones de formación de complejos, y sus mecanismos de reacción. Desde el punto de vista de la cinética, los complejos de coordinación pueden dividirse en:
- Lábiles: Su velocidad de descomposición (en el sentido de los equilibrios) es elevada. No hay un convenio establecido acerca de qué velocidad se considera elevada, dependiendo del texto se considera una descomposición total en 5 segundos, pero no es una medida rigurosa de velocidad en química.
- Inertes: Su velocidad de descomposición es muy baja. Tampoco existe un convenio establecido, pero en muchas ocasiones se considera un complejo inerte aquél que es capaz de ser aislado y caracterizado en atmósfera oxidante, y sus propiedades se mantienen constantes con el tiempo.
Termodinámica: Estudia las energías puestas en juego en las reacciones de formación/descomposición, así como las relaciones de compuestos en el equilibrio. Por tanto es la parte que más interesa a un químico analítico. En esta parte relacionaremos conceptos de termodinámica química de reactivos y productos.
- Será un complejo estable aquél cuya energía libre de Gibbs sea menor que la que presentaban los reactivos por separado.
- A cambio, un complejo será inestable cuando su energía de Gibbs sea mayor que la que tuvieran los reactivos por separado. (Relacionar estos conceptos con los diagramas E-CR).
Como podemos observar un complejo de coordinación puede ser termodinámicamente inestable, pero no descomponerse porque sea cinéticamente inerte. Los dos campos de estudio no son incompatibles.
Constantes de los equilibrios de formación de complejos: Los equilibrios de formación de complejos están caracterizados por tener constantes termodinámicas muy elevadas, por eso en muchas ocasiones se estudia su relación con la solubilidad de precipitados insolubles.
Para un equilibrio genérico del tipo M + L = ML, donde M es el átomo metálico coordinante y L el ligando (iones, moléculas o radicales), la constante termodinámica vendrá expresada en función de su actividad.
ACTIVIDAD 9:
El alumno realizara practicas de formacion de complejos en el aula o laboratorio asi como la discusión en clase con el resto de compañeros y aportación del maestro.
Referencias:
- Análisis Gravimétrico. Recopilado en Oct. 20, 2008 de: http://es.wikipedia.org/wiki/Análisis_gravimétrico
- Análisis Volumétrico. Recopilado en Oct. 20, 2008 de: http://es.wikiversity.org/wiki/Principios_del_análisis_volumétrico
- Ácidos y Bases. Recopilado en Oct. 20, 2008 de: http://201.116.18.153/laciencia/quimica/qe-7.htm
- Reacciones Redox. Recopilado en Oct. 20, 2008 de:
http://201.116.18.153/laciencia/quimica/qe-8.htm
- Reacciones de Precipitación. Recopilado en Oct. 20, 2008 de:
http://www.uia.mx/campus/publicaciones/quimanal/pdf/6reaccionesprecipitacion.pdf
- Reacciones de Complejos. Recopilado en Oct. 20, 2008 de:
http://es.wikipedia.org/wiki/Equilibrio_de_complejos